Це правильно, існує ряд небажаних металевих металів (Cu, Sn, Sb, As), які потрапляють у потік переробки, наприклад, з кузовів автомобілів, які перемелюються в брухт, не видаляючи всю мідну проводку, або олово сталеві банки з покриттям. Сурма та миш’як, як правило, повзають з низькоякісних та дешевих первинних джерел заліза.
Відповідь на питання - ні. Перероблену сталь змішують максимально рівномірно з різних джерел, вимірюють її склад, а потім додають чисте залізо за необхідності для розведення батутних металів до допустимих рівнів для перепродажу або подальшої переробки, наприклад, для досягнення конкретного сорту сталі для конкретного продукту або додаток. Нержавіючі сталі та інші високолеговані марки, які відомі під час переробки, обробляються окремо через значення Ni, Cr тощо.
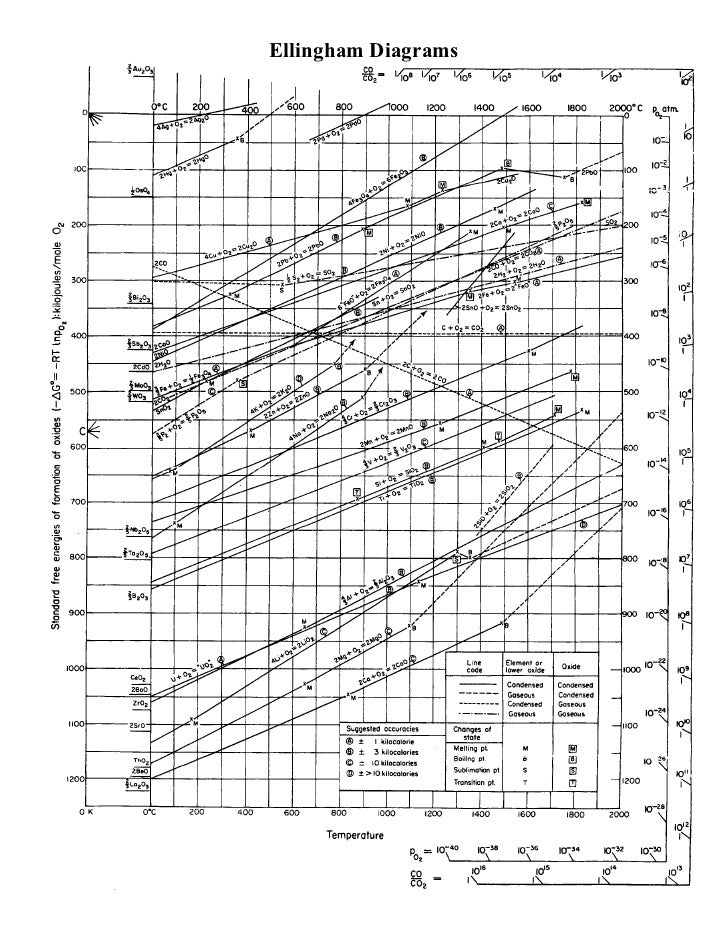
Наразі переробляти залізо в даний час неекономічно, щоб видалити елементи батута, і це просто зовсім не робиться. У двох книгах згадується процес як звичайний та економічний: ( Корисні копалини, метали та стійкість: задоволення майбутніх матеріальних потреб , стор. 284, починаючи з «розведення») та ( Виробництво сталі: процеси, продукти та залишки, починаючи з с. 104, читайте, поки це вже не актуально). Причина неекономічна в тому, що батутні елементи реагують слабкіше з киснем, ніж залізо при постійній температурі, тому для їх видалення шляхом окислення потрібно спочатку окислити все залізо. Причиною цього є термодинаміка, яка полягає в тому, що серед конкуруючих реакцій ті, у кого найбільше зниження вільної енергії, переходять практично до завершення до початку інших реакцій, особливо з великими відмінностями вільної енергії серед конкуруючих реакцій. Щоб визначити, які реакції мають найбільше зменшення, може бути використана діаграма Еллінгема.
На діаграмі Еллінгема нижче горизонтальна вісь - це температура, вертикальна вісь - зміна вільної енергії Гіббса. Лінії, що проходять по діаграмі під різними кутами, відповідають вільній зміні енергії, спричиненій реакціями окислення елементів киснем, як функція температури. У нашому випадку діаграму можна прочитати, вибравши температуру, що цікавить, і прочитавши знизу, щоб знайти перший елемент, що реагує на кисень. Наприклад, якщо у нас є сталь з Fe, Mn, Sn і Cu, ми можемо побачити, що при 1000K тоді Mn, Fe (до FeO), Sn і Cu - це порядок найбільшого до найменшого падіння вільної енергії.
Зрозуміло, що температура, що цікавить, наближається до 1900 К (вище температури плавлення заліза), але загальні тенденції кожної функції вільної зміни енергії Гіббса продовжуються праворуч на схемі, і залізо залишається нижче баламутних елементів Cu, Sn, As і Sb при практичній температурі та, ймовірно, до відповідних температур кипіння. Як результат, для видалення батутів із Fe потрібно спочатку ефективно окислити все залізо. А оскільки Sn, Sb, As і Cu слабо розчиняються в залізі, вони потребують поділу за допомогою хімічної реакції.
Видно розчинність батутів із їхніх фазових діаграм із залізом, про які я розмістив Sb-Fe нижче. Діаграма має температуру відносно складу, при цьому кожна суміжна 2D область складається з однієї фази, або суміші двох фаз зліва та справа, які знаходяться в рівновазі при цій комбінації температури та складу. У нижньому лівому куті ми бачимо, що для невеликих кількостей Sb і кімнатної температури є сусідня область, яка в даному випадку позначає одну фазу, або альфа-Fe (такий, який ми знайомі). Оскільки присутній Sb, і він знаходиться в одній фазі, він повинен бути розчинений в залізі. Те ж саме, з різною суворістю, стосується інших бродяг.

(джерело: himikatus.ru )
Як зауважив Кріс Н, виникає також питання, коли контролюються інші легуючі елементи. Як правило, додавання сплаву контролюється якомога ближче до затвердіння, щоб мінімізувати втрати сплаву.
Лом плавиться оптом в електродуговій печі. Якщо потік брухту є достатньо змішаним, то концентрацію бродяги можна оцінити, виходячи з минулого використання, і первинне залізо додається перед хімічним аналізом для компенсації оцінки. Потім основна маса плавиться, кисень видаляється за допомогою додавання елементів у нижній частині діаграми Еллінгема, зокрема Са та Al, і розплавлений метал переноситься на один або кілька високоізольованих ковшів. Са та Al швидко реагують з розчиненим у розплаві киснем, утворюючи оксидний шлак низької щільності, який плаває і видаляється механічно. Хімія береться після цього процесу, і якщо бродяги досить розведені, метал переноситься на ковші. Якщо ні, для розведення розплаву додається достатня кількість первинного заліза.
Потрапивши в ковш, додаються додаткові легуючі елементи. Вони не додаються раніше через діаграму Еллінгема: більшість легуючих елементів, включаючи Mn, Mo, Cr, V, C тощо, мають більшу втрату вільної енергії, ніж Fe, і тому реагують спочатку. Іншими словами, вони в’януть. Щоб уникнути вицвіння дорогого сплаву, їх додають якомога ближче до процесу затвердіння. Крім того, видаляючи кисень, використовуючи спочатку Al та Ca, в заліза менше розчиняється кисню, щоб реагувати з більш дорогими легуючими елементами. Потрапивши в ковш, спостерігається дуже мало турбулентності інтерфейсу рідкої атмосфери, тому дифузія нового кисню в рідке залізо відбувається досить повільно. Звичайно, існує ще обмеження в часі, і якщо затримувати ковш занадто довго, це призведе до вицвітання сплаву. Після додавання сплаву перевіряють хімію, а потім заливають ковш.
Відредаговано, щоб додати джерела. Відредаговано, щоб додати обговорення контролю сплаву.

